2 de marzo, 2021
11 minutos
Data integrity en la industria farmacéutica según la FDA
La Integridad de Datos (o Data Integrity) es una prioridad de las entidades reguladoras europeas y americanas desde hace varios años.
Las warning letters emitidas por la FDA tras las inspecciones realizadas en los años 2013-2014 a laboratorios situados en India, pusieron el foco en este tema.
Actualmente continúan siendo muy numerosas las desviaciones y observaciones sobre integridad de datos que aparecen en las inspecciones, y que pueden encontrarse en la revisión de informes de incumplimiento GMP (Non-compliance EudraGMDP), FDA-483 y warning letters.
Desde el año 2015, autoridades reguladoras, asociaciones y organizaciones han publicado varia información para resolver dudas, así como guías relacionadas con este asunto. Durante el 2018, algunos de los borradores han sido aceptados y algunos de los documentos han sido actualizados, como veremos a continuación.
Por ejemplo, en abril de 2016 la FDA publicó el primer borrador de la guía: “Data Integrity and Compliance with cGMP”, que fue actualizado y publicado ya como guía definitiva el mes de Diciembre de 2018 con el título: “Data Integrity and Compliance With Drug cGMP. Questions and Answers. Guidance for Industry” (4)
Se trata de una guía que incide en la necesidad de realizar controles sobre los términos relacionados con el concepto ALCOA, atendiendo a las carencias de Data Integrity que se detectan en diferentes inspecciones.
El concepto ALCOA es común en la industria farmacéutica. Estos son unos principios básicos recomendados por agencias regulatorias como la FDA y la EMA para asegurar la buena gestión de los datos.
Se trata de un amplio listado de requisitos que ayudan a las empresas a asegurar la calidad de la documentación relacionada con los productos farmacéuticos y a garantizar la integridad de los datos que se generan y que se consideran críticos tanto en formato papel como electrónico.
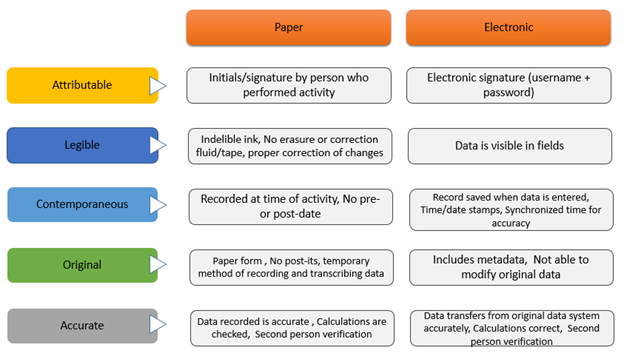
Según la guía “Data Integrity and compliance with cGMP” ya mencionada anteriormente de la FDA, para cumplir con la integridad de datos en el sector farmacéutico la información debe ser:
- (A) Atribuible: significa que debe quedar trazado quien creó el registro, cuándo y por qué. Asimismo, se debe saber si la generación del dato fue por una modificación o creación.
- (L) Legible: el registro debe ser permanente y comprensible. Además, debe estar accesible durante todo su ciclo de vida.
- (C) Contemporáneo: el registro debe realizarse en el momento en que se lleva a cabo una actividad. No hacerlo oportunamente podría afectar la precisión del registro, ya que hay detalles que se pueden olvidar.
- (O) Original: el primer registro del dato, con su contenido original, debe conservarse siempre.
- (A) Accurate (exactos, precisos): los datos no deben contener errores y además deben ser completos, veraces y reflejar de manera precisa la observación.
Además, a través de esta guía, se pueden observar otros aspectos, como son:
- Definición de ‘Data Integrity’, ‘Metadata’, datos ‘estáticos y dinámicos’.
- Validación del sistema informático. Debe ser validado para su uso previsto, mencionando los sistemas que gestionan ‘workflows’ para validarlos desde la óptica GMP.
- Revisión del ‘audit trail’, siendo una parte más del proceso de aprobación de la documentación que constituye el registro GMP.
- Apartado de los HPLC (high-performance liquid chromatography, en inglés). Vuelve a insistir que se debe de disponer de toda la información generada durante el proceso cromatográfico.
- Aclaraciones de los puntos de la norma (21 CFR 211) en los que se solicitan los conceptos de la ALCOA.
Esta guía enfatiza la aproximación que la FDA hace tiempo ha adoptado respecto al proceso de Data Integrity, pero que formalmente no se había manifestado en una guía específica. Por lo que el documento sirve de ayuda para interpretar algunas dudas que han ido apareciendo por el camino.
De este modo, la industria ya dispone de las perspectivas oficiales de la FDA, que complementa las de la MHRA y la OMS, marcando de forma inequívoca las acciones que el sector farmacéutico debe adoptar.
Otras guías de referencia
La Organización Mundial de la Salud (WHO) lanzó , en junio de 2016, la guía “Guidance on Good Data and Record Management Practices” Annex 5. (Who Technical Report Series No. 996.2016).
En julio del 2016, la agencia británica, MHRA, publicó el borrador del documento para consulta: “MHRA GxP Data Integrity Definitions and Guidance for Industry”. Dicho borrador se presentó 18 meses después de la publicación de la guía: “MHRA GMP Data Integrity Definitions and Guidance for Industry”.
La novedad consistió en la revisión de la integridad de datos con un enfoque más global, un enfoque GxP (Normas de Correcta Fabricación, Buenas Prácticas de Laboratorio, Buenas Prácticas de Distribución, Buenas Prácticas Clínicas y Buenas Prácticas de Farmacovigilancia). El documento definitivo se publicó en marzo de 2018: “GxP Data Integrity Guidance and Definitions”.
La Agencia Europea de Medicamentos (EMA), en su sección de preguntas y respuestas sobre GMP, incluyó en agosto de 2016, 23 preguntas y respuestas relacionadas con la integridad de datos, el ciclo de vida de los datos y otras cuestiones.
Por otro lado, existe el borrador publicado por PIC/S (Pharmaceutical Inspection Convention/ Pharmaceutical Inspection Cooperation Scheme) en agosto de 2016, estaba pensado como guía para inspectores: “Good Practices for Data Management and Integrity in regulated GMP/GDP environments”. Este borrador fue actualizado en noviembre de 2018.
Por último, ISPE (International Society for Pharmaceutical Engineering) publicó en marzo de 2017 una nueva guía GAMP: “Records and Data Integrity Guidance”, que sustituyó a la guía de registros y firma electrónica, y que consideró las versiones anteriores a 2017 de las guías mencionadas.
Usar los datos para optimizar los procesos
Como has visto, implementar buenas prácticas de data integrity permite a las empresas tener datos fiables y asegurar la calidad de sus procesos. De este modo, la empresa se siente protegida y puede pasar al siguiente nivel y aprovechar la integridad de datos para solucionar problemas operativos.
Para ello, cada vez más los fabricantes están abandonando el papel y digitalizando sus procesos. Los sistemas informatizados permiten ahorrar costes para recopilar datos y aumentan la capacidad para analizarlos y aprovecharlos para mejorar el negocio.
AMBIT BST
En AMBIT somos expertos desde hace más de 15 años en el desarrollo de estrategias y soluciones IT para tu compañía. Somos consultores e integradores en múltiples ámbitos, y si quieres conocer más de las soluciones que te podemos ofrecer, no dudes en ponerte en contacto con nosotros.
En Ambit BST, podemos ayudarte a garantizar la integridad de tus datos y optimizar tus procesos. Contáctanos y te ayudaremos con todo lo necesario.













.png)







.png)
Cuéntanos tu opinión