1 de octubre, 2020
10 minutos
EUDAMED: qué debes saber para prepararte
EUDAMED es un sistema TI concebido por la Comisión Europea, una gran base de datos sobre productos sanitarios y productos sanitarios de diagnóstico in vitro del mercado único.
Al mismo tiempo una plataforma para la comunicación entre los distintos agentes implicados (fabricantes, organismos notificados, autoridades…), y que permitirá implementar los Reglamentos (UE) 2017/745 y 2017/746 para productos sanitarios y productos sanitarios para diagnóstico in vitro respectivamente.
EUDAMED, ¿cuáles son sus objetivos?
Con la implantación de EUDAMED también desaparecerán los sistemas nacionales de registro de productos sanitarios y el sistema actual de vigilancia Eudamed2.
Los objetivos que persigue están recogidos en el propio Reglamento (UE) 2017/745:
- Hacer posible que el público esté adecuadamente informado sobre los productos introducidos en el mercado, los certificados correspondientes expedidos por organismos notificados y los agentes económicos pertinentes
- Permitir la identificación única de los productos en el mercado interior y facilitar su trazabilidad.
- Hacer posible que el público esté bien informado de las investigaciones clínicas y permitir a sus promotores cumplir las obligaciones previstas
- Permitir que los fabricantes cumplan las obligaciones de información establecidas
- Hacer posible que las autoridades competentes de los Estados miembros y la Comisión desempeñen sus tareas en relación con el reglamento con conocimiento de causa y reforzar la cooperación entre ellos.
Así, se espera que EUDAMED mejore la trazabilidad y transparencia de los productos sanitarios en el mercado de la Unión y la coordinación entre los distintos agentes implicados.
¿Cómo está estructurada?
EUDAMED está compuesta por seis módulos interconectados:
- Registro de actores (ACT) - Incluirá a los actores económicos de los productos sanitarios del mercado, en particular de fabricantes, representantes autorizados, importadores y productores de kits y sistemas para procedimientos, y será parcialmente pública. Los actores económicos implicados deberán estar registrados antes de introducir un producto en el mercado, y a cada actor se le asignará un número de registro único (SRN).
- Registro UDI/productos (UDID) -Una base de datos de los productos sanitarios en el mercado de la Unión, incluyendo los kits y sistemas para procedimientos. Estará dividido en dos submódulos: uno para registro de productos, de carácter más restringido, y el módulo UDI, de carácter totalmente público. Los productos que se vayan a introducir en el mercado deberán ser registrados en este módulo, incluyendo los datos de UDI-DI.
- Organismos Notificados y certificados (CRF) - Incluirá a los organismos notificados competentes y los certificados emitidos por los mismos, y servirá como plataforma para la comunicación entre organismos notificados, paneles de expertos y autoridades. Será de carácter parcialmente público.
- Investigaciones clínicas y estudios de funcionamiento (CIPS) - Servirá de plataforma de comunicación entre el promotor de investigaciones clínicas y estudios de funcionamiento y las autoridades sobre dichas investigaciones o estudios . Algunos documentos serán de carácter público.
- Vigilancia y seguimiento poscomercialización (VGL) - Será la plataforma que permitirá el intercambio de información relativa a vigilancia entre fabricantes, organismos notificados y autoridades, donde los fabricantes enviarán información sobre productos en el mercado como informes de incidentes graves y acciones correctivas de seguridad, informes periódicos de seguridad, informes de tendencia, o notas de seguridad. Será parcialmente público, en particular las notas de seguridad serán accesibles al público general.
- Seguimiento de mercado (MSU) - Servirá como plataforma de comunicación entre autoridades sobre las acciones de seguimiento de mercado que éstas realizan, y su difusión pública se limitará a los resúmenes de las actividades de seguimiento de mercado.
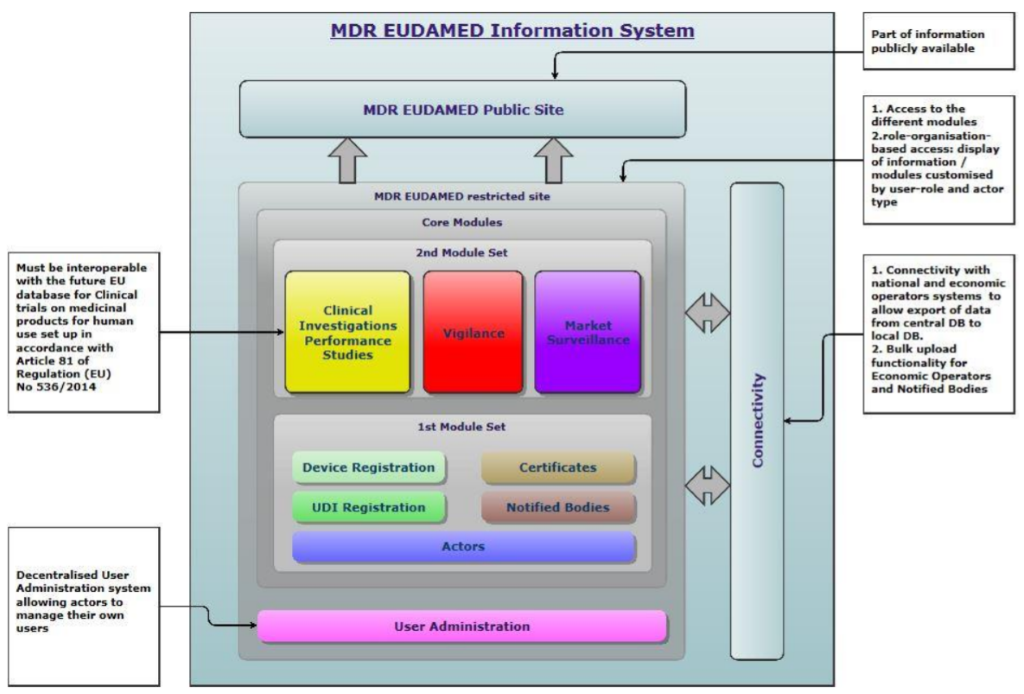
Fig. 1 - Estructura de EUDAMED. Fuente: Comisión Europea.
¿Qué obligaciones se contemplan para los fabricantes con respecto a EUDAMED?
Los fabricantes de productos sanitarios y productos sanitarios de diagnóstico in vitro deberán cumplir con numerosas obligaciones en cuanto al ingreso de información en EUDAMED y deberán mantener dicha información actual. Fabricantes no registrados no podrán registrar productos, y productos no registrados no podrán introducirse en el mercado único.
El mayor desafío que afrontarán será posiblemente ingresar y mantener los datos del registro de productos/UDI, en especial aquéllos con gran número de productos y modelos. Los datos a ingresar incluyen tanto datos poco susceptibles a cambios, como la clase de riesgo, nombre del producto o plantas de fabricación, como otros que lo son algo más, como cambios en las advertencias, en los Estados miembros donde se comercializará o en el estatus del producto (p.e. si un modelo se descataloga o le aplica una acción de campo).
En el siguiente enlace se puede ver un resumen (en inglés) de los datos que contempla el módulo UDID para:
- Productos sanitarios bajo el Reglamento (UE) 2017/745: https://ec.europa.eu/health/sites/health/files/md_eudamed/docs/md_budi_mdr_en.pdf
- Productos sanitarios de diagnóstico in vitro bajo el Reglamento (UE) 2017/746: https://ec.europa.eu/health/sites/health/files/md_eudamed/docs/md_budi_ivdr_en.pdf
¿Cuándo estará operativa EUDAMED y cuándo será obligatoria?
Los distintos módulos de EUDAMED no estarán disponibles al mismo tiempo. El primer módulo disponible será el de actores (ACT), cuyo despliegue está planeado para diciembre de este año. A continuación se activarán los módulos de UDI/productos (UDID) y Organismos Notificados / Certificados (CRF), planeados para mayo de 2021.
Los módulos restantes se irán activando tan pronto como sean funcionales, no habiendo en la actualidad información oficial concreta sobre la fecha en que EUDAMED sea plenamente operativa, aunque se baraja mayo de 2022.
La puesta en funcionamiento gradual de EUDAMED y el retraso que arrastra, pues estaba prevista inicialmente para el 26 de mayo de 2020 para productos sanitarios, genera dudas sobre la fecha de obligatoriedad.
Las fechas consideradas en los reglamentos para la plena operatividad y aplicación de EUDAMED son el 26 de mayo de 2021 para productos sanitarios y el 26 de mayo de 2022 para productos sanitarios de diagnóstico in vitro, contemplándose un periodo adicional de 18 meses (26 de noviembre de 2022) para la obligatoriedad del módulo UDID.
Dado el grado de desarrollo actual, donde sólo 3 de los 6 módulos podrían estar operativos en mayo de 2021, parece altamente improbable que el 26 de mayo de 2021 esté plenamente operativa EUDAMED, pero el reglamento ya establece un mecanismo en el caso de retraso: un anuncio en el Diario Oficial de la Unión Europea, que se publicaría una vez comprobada la funcionalidad de EUDAMED y el cumplimiento de las especificaciones (aún en borrador), previa consulta con el Medical Device Coordination Group.
En este caso la obligatoriedad general se retrasaría 6 meses desde la publicación del anuncio y 24 meses para el módulo UDID. Es decir, como muy pronto, los datos en el módulo UDID deberían ingresarse antes del 26 de noviembre de 2022, pero esta fecha podría retrasarse considerablemente.
En cualquier caso, la utilización de EUDAMED puede ser necesaria antes de ser obligatoria. Puesto que se espera el despliegue del módulo ACT en diciembre de este año y el módulo UDID para mayo de 2021.
Aquellos fabricantes que planeen certificar productos bajo los nuevos reglamentos en los próximos meses, tanto productos nuevos como productos presentes en el mercado bajo las directivas, se encontrarán previsiblemente con la demanda de los organismos notificados de estar registrados en EUDAMED y de haber ingresado los datos del producto en la misma, puesto que es relevante para la evaluación de conformidad.
Para evitar retrasos no deseados en el lanzamiento o certificación de productos, se recomienda a las fabricantes hacer los preparativos lo antes posible y utilizar los distintos módulos de EUDAMED tan pronto como vayan estando disponibles, considerando los retos que podrían enfrentar sin una planificación adecuada, en especial en lo que respecta al ingreso y mantenimiento de los datos en el módulo UDID.
¿Cómo se ingresarán o descargarán los datos en EUDAMED?
EUDAMED ofrece múltiples vías para ingresar o descargar datos:
- De forma manual a través de la interfaz de usuario. Esta vía requiere únicamente de un ordenador con conexión a internet y navegador. Esta puede ser suficiente para usuarios que no requieran transmitir gran cantidad de datos a EUDAMED.
- De forma semiautomática, mediante la subida o descarga manual de archivos XML. Para ello el archivo XML debe ser validado frente al servicio EUDAMED DTX y al modelo de entidades XSD, y generalmente requeriría de un software específico para facilitar la tarea de lectura de los archivos XML. Esta vía es recomendable cuando se espera un ingreso de datos inicial considerable pero pocos cambios posteriores.
- De forma automática con un sistema "máquina a máquina" (M2M). En este caso, el usuario podría ingresar información en un sistema externo conectado por un punto de acceso, que podría transmitir la información a EUDAMED directamente en formato XML. Esta vía supone mayor complejidad al implicar aspectos de interoperabilidad, seguridad, mantenimiento etc., pero es recomendable cuando se prevé un intercambio frecuente de gran cantidad de datos.
Más información sobre el intercambio de datos puede encontrarse en la guía siguiente:
https://ec.europa.eu/health/sites/health/files/md_eudamed/docs/md_eudamed_guidelines_dtx_en.pdf
Enlace al portal sobre EUDAMED de la Comisión Europea:
https://ec.europa.eu/health/md_eudamed/overview
AMBIT BST
En AMBIT somos expertos desde hace más de 15 años en el desarrollo de estrategias y soluciones IT para tu compañía. Somos consultores e integradores en múltiples ámbitos, y si quieres conocer más de las soluciones que te podemos ofrecer, no dudes en ponerte en contacto con nosotros.













.png)





.png)
Cuéntanos tu opinión