7 de julio, 2020
13 minutos
Producto sanitario y emergencia sanitaria ocasionada por el COVID-19
En un movimiento sin precedentes en España, debido a la pandemia provocada por la COVID-19 y a la gran demanda de producto sanitario (sobre todo sistemas y productos barrera, además de respiradores artificiales) se han producido acciones por todo el país con una carga solidaria absolutamente emocionante.
Nos referimos, concretamente, a cadenas de solidaridad para fabricar material de protección hecho con impresoras 3D. Miles de voluntarios, de manera absolutamente altruista, han destinado su tiempo, recursos, experiencia y conocimiento para diseñar, fabricar y distribuir material de protección sanitario en 3D. Se han fabricado, en tiempo récord, visores protectores, mascarillas reutilizables, accesorios para respiradores artificiales.
Aumento de la demanda de producto sanitario. Reacciones sin precedentes
Estos productos han podido llegar a los lugares de necesidad, entre los que se encuentran centros médicos, residencias de tercera edad, centros de coordinación de transporte público, etc. contribuyendo a disminuir la gran demanda que había de estos productos. No puedo continuar estas líneas sin dar mi más sincero agradecimiento a todas estas personas que, sin duda, se han convertido en un referente solidario que no olvidaremos.
Los productos que tienen como fin médico específico, entre otros, la prevención, tratamiento o alivio de una enfermedad y que no ejercen su acción principal prevista en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales mecanismos, son productos sanitarios.
Los productos citados anteriormente cumplen con la definición, siendo por lo tanto productos sanitarios y como tales están sujetos a una regulación muy estricta. Tal regulación nos protege como pacientes y usuarios y, a la vez, establece unos requisitos exigentes a los distintos agentes económicos que la misma regulación identifica (fabricantes, distribuidores, representantes autorizados o importadores).
Regulación que aplica a los productos sanitarios
El hecho de que estos productos sean producto sanitario ha provocado una situación compleja, dado que la gran demanda de los mismos, que se presentó al inicio de la pandemia en España debía ser atendida de forma extremadamente rápida y con productos conformes a la regulación, garantizando en todo momento eficacia y seguridad al paciente y usuario.
El cumplimiento regulatorio de un producto sanitario desde cero, no es un proceso especialmente ágil. Para un producto de riesgo medio-alto, puede fácilmente rondar los 15-18 meses hasta que se consigue marcado CE. Hay que decir, no obstante, que las exigencias regulatorias establecen, en función del riesgo, diferentes categorías, de forma que los requisitos son más o menos exigentes en función de la misma.
En Europa la regulación existen tres Directivas que regulan el producto sanitario.
- Directiva 90/385/CEE para productos sanitarios implantables activos.
- Directiva 93/42/CEE para a los productos sanitarios.
- Directiva 98/79/CE para productos sanitarios de diagnóstico in vitro.
Estas Directivas, todavía vigentes, serán sustituidas por dos Reglamentos:
- Reglamento (UE) 2017/745 para producto sanitario y por el que se derogan las Directivas 90/385/CEE y 93/42/CEE (entrada en aplicación 26 de mayo de 2021)
- Reglamento (UE) 2017/746 para producto sanitario de diagnóstico in vitro por el que se deroga la Directiva 98/79/CE (entrada en aplicación 26 de mayo de 2022)
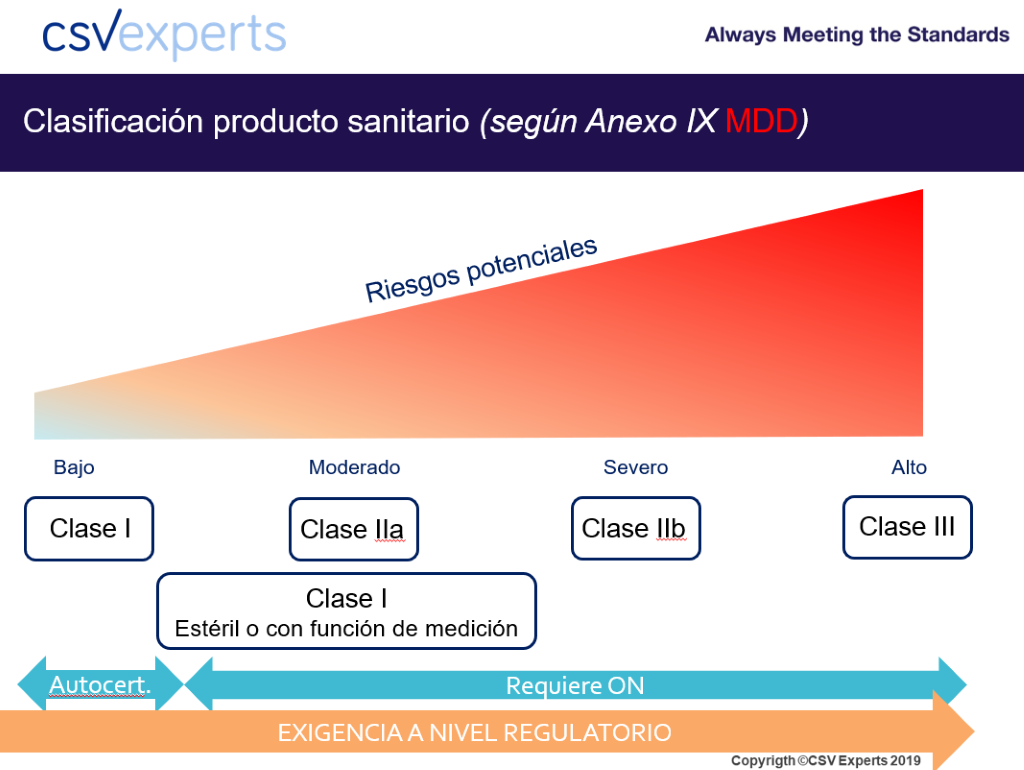
En Europa existen cuatro categorías o clases distintas de menor a mayor riesgo: I, IIa, IIb y III. Un producto clase I que no sea estéril y que no tenga función de medición es un producto autocertificado, lo que significa que es el propio fabricante el que declara conformidad. No se requiere intervención de terceras partes.
En cambio, en el resto de los productos (clases IIa, IIb y III, así como clases I estériles o con función de medición) para declarar conformidad del producto debe intervenir un Organismo Notificado (ON o NB atendiendo al término en inglés, Notified Body).
Esfuerzo de las empresas y de las autoridades sanitarias
Además de las cadenas de solidaridad espontáneas, comentadas al inicio de este artículo, centenares de empresas han estado haciendo, y continúan haciendo un esfuerzo extraordinario en la producción de producto sanitario para el combate contra el coronavirus.
algunas lo fabrican habitualmente, pero para muchas es un campo nuevo, lo que ha implicado, y sigue implicando, un gran esfuerzo para que dichas empresas cumplan con las exigencias de la regulación. Es el caso de empresas con capacidad y tecnología para fabricar mascarillas higiénicas, guantes, batas, soluciones desinfectantes e incluso, a un nivel de mayor complejidad y exigencia regulatoria, respiradores artificiales.
El escenario comentado ha requerido también una labor de gran esfuerzo para las autoridades regulatorias, las cuales han dado y están dando absoluta prioridad a la evaluación de cumplimiento (expedientes técnicos, licencia previa de funcionamiento de instalaciones de fabricantes de producto sanitario, sistemas de gestión de la calidad) para todos aquellos productos relacionados con la lucha del coronavirus.
Además, desde mediados de marzo, son continuas las notas informativas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en relación al COVID-19. Por ejemplo, relativas a recomendaciones de actuación en la industria de producción y distribución farmacéutica ante casos de infección por COVID-19; información sobre el suministro de mascarillas, guantes y soluciones desinfectantes a fabricantes de medicamentos, principios activos, productos sanitarios o biocidas;
Información sobre la situación actual (1 abril 2020) de evaluación de respiradores artificiales en proceso de autorización por la AEMPS; se establecen medidas excepcionales para agilizar las autorizaciones de productos antisépticos de piel sana; se informa sobre las medidas especiales para la fabricación y utilización de mascarillas quirúrgicas y batas quirúrgicas; se informa sobre las actuaciones de la AEMPS en relación a las mascarillas quirúrgicas en la situación de emergencia sanitaria ocasionada por el COVID-19.
También se informa sobre las medidas llevadas a cabo para aumentar la disponibilidad de geles y soluciones hidroalcohólicas; participación por parte de la AEMPS en dos workshops internacionales para potenciar el desarrollo de tratamientos y vacunas contra COVID-19; celebración, por parte de la AEMPS, de un encuentro extraordinario con los 22 países iberoamericanos para impulsar la colaboración internacional contra la COVID-19; se informa sobre las medidas adoptadas para facilitar la gestión de las autorizaciones y modificaciones de medicamentos de uso humano considerados esenciales durante la crisis de COVID-19;
Además, se informa del aplazamiento en la entrada en aplicación del Reglamento (UE) 2017/745 sobre los productos sanitarios; se realizan actuaciones por parte de la AEMPS para agilizar y fomentar los ensayos clínicos y estudios observacionales sobre COVID-19; medidas excepcionales aplicables a los ensayos clínicos para gestionar los problemas derivados de la emergencia por COVID-19, etc.
La situación de emergencia sanitaria ocasionada por el COVID-19, ha aumentado de manera importante el riesgo de que se introduzcan en el mercado productos sanitarios utilizados principalmente para la prevención y/o tratamiento del COVID-19 que no cumplen con la legislación vigente y que pueden suponer un riesgo de salud pública.
La AEMPS continúa con su importante labor de detección de productos que estando en el mercado no cumplen regulación. El pasado 10 de junio, la AEMPS publicó un listado de productos sanitarios (mascarillas quirúrgicas, batas, guantes, etc.) especialmente utilizados durante COVID-19 y que no cumplen regulación.
En el 70% de los casos se trata de productos fabricados fuera de la Unión Europea y que requieren un representante autorizado dentro de Europa que asegure el cumplimiento de la regulación específica de aplicación al mercado europeo.
Los principales incumplimientos detectados están relacionados con certificados de marcado CE falsos, declaraciones de conformidad con información falsa, marcados CE indebidos como producto sanitario y el no disponer de representante autorizado en la Unión Europea (UE) cuando el fabricante carece de domicilio social en la UE o que el representante autorizado que figura en el etiquetado sea inadecuado.
También se han detectado en el mercado tests para el diagnóstico de COVID-19 que tampoco cumplen regulación. En este caso, el 100% de los casos corresponden a fabricantes de fuera de la Unión Europea. Se detectan nuevamente datos falsos, bien en relación con el representante autorizado o bien en relación con su uso, indicándose como autodiagnóstico cuando se trata de un producto para uso profesional.
Conclusiones
Es muy importante, por lo tanto, entender que un producto sanitario entraña, en mayor o menor medida, riesgos para el paciente o usuario. Es totalmente necesario que cualquier producto sanitario cumpla la regulación.
Esta regulación asegura, entre otros, que el fabricante ha evaluado y mitigado los riesgos, ha realizado una evaluación clínica del producto (de forma que demuestra seguridad y eficacia de este), cumple los estándares que aplican al producto, diseña el material necesario para informar del uso correcto al usuario, diseña una etiqueta conforme a la regulación y que, por lo tanto, se identifica correctamente al fabricante así como la fecha de caducidad, trazabilidad del producto (número de lote o número de serie), marca CE identificando el codigo del ON si aplica, etc.
La exigente regulación redunda en una mayor protección de todos nosotros.
AMBIT BST
En AMBIT somos expertos desde hace más de 15 años en el desarrollo de estrategias y soluciones IT para tu compañía. Estamos especializados en liderar la transformación digital del sector salud, farmacéutico y de productos sanitarios para el estricto cumplimiento de las normativas que rigen los entornos GxP.
Si estas interesado en un software cloud que obedezca a estos requisitos, te recomendamos que te descargues este ebook gratuito sobre las ventajas de GxPharma Cloud.













.png)







.png)
Cuéntanos tu opinión